вїcuгўles Son Las Relaciones Entre Reactivos Y Productos

вљ пёџ Reactivos Y Productos рџ ґ вїquг Son Diferencias Ecuaciones Quгќmicas En todas las reacciones químicas unas sustancias son llamadas reactivos o reactantes y las que se transforman se llaman productos. al ser diferentes los reactivos de los productos, presentan propiedades distintas, algunas de estas diferencias se pueden percibir de manera sencilla en cambios de color, olor, densidad, viscosidad, entre otras. Los productos son las sustancias que se forman cuando los reactivos se combinan en una reacción química. los productos pueden ser sólidos, líquidos o gases, y pueden ser simples o compuestos. los productos son importantes porque determinan el éxito de una reacción química y pueden ser utilizados para predecir futuras reacciones químicas.
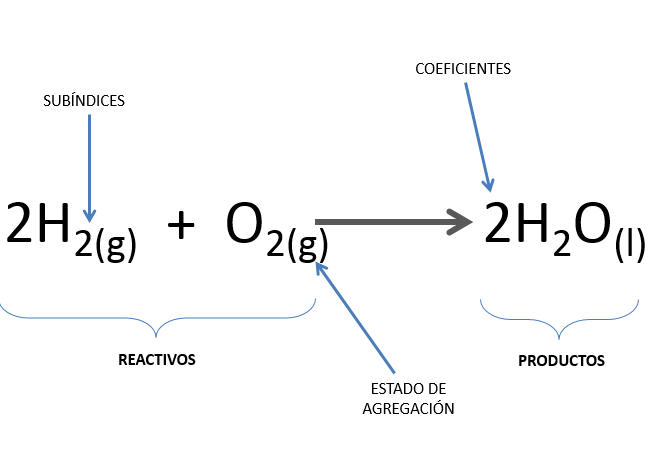
вїcuгўles Son Las Relaciones Entre Reactivos Y Productos N Al ser diferentes los reactivos de los productos, presentan propiedades distintas, algunas de estas diferencias se pueden percibir de manera sencilla en cambios de color, olor, densidad, viscosidad, entre otras. generalmente los reactivos se escriben a la izquierda y los productos a la derecha y los separa una flecha la cual indica que ocurrió. Un reactivo es una sustancia que está presente al inicio de una reacción química. la (s) sustancia (s) a la derecha de la flecha se denominan productos. un producto es una sustancia que está presente al final de una reacción química. en la ecuación anterior, el zinc y el azufre son los reactivos que se combinan químicamente para formar. Las leyes ponderales o estequiométricas son unas leyes que se aplican a las reacciones químicas y que consideran las masas de las sustancias que reaccionan. ley de conservación de la masa "la ley de conservación de la masa o ley de lavoisier dice que la masa de los compuestos que forman parte de la reacción se conserva .". Un ejemplo clásico de reacción química es la combustión del gas metano (ch4) en presencia de oxígeno (o2) para formar dióxido de carbono (co2) y agua (h2o). en esta reacción, el metano y el oxígeno son los reactivos, mientras que el dióxido de carbono y el agua son los productos. ch4 2o2 → co2 2h2o.

Comments are closed.