Perbandingan Massa Unsur Oksigen Dalam Dua Senyawa
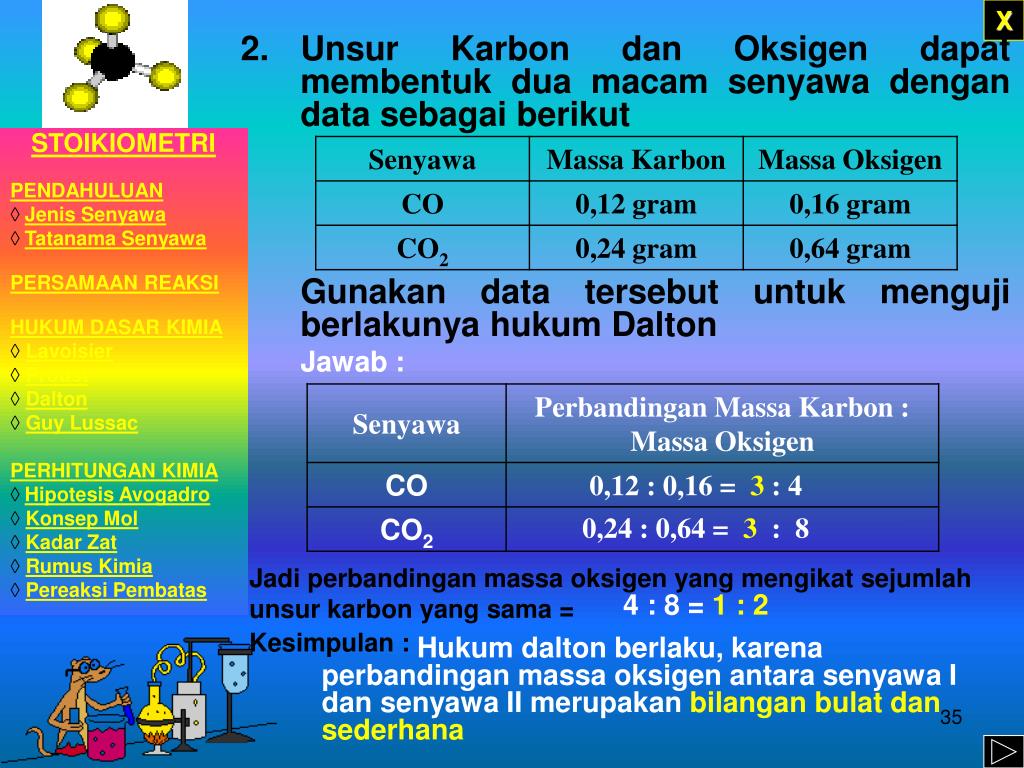
Perbandingan Massa Unsur Oksigen Dalam Dua Senyawa Tersebut Sesuai Pengertian hukum dalton. hukum dalton adalah hukum yang menyatakan apabila unsur unsur dapat membentuk beberapa senyawa dan massa salah satu unsur selalu tetap, perbandingan massa unsur yang lain dapat dinyatakan dalam bilangan bulat dan sederhana. hukum ini dirumuskan oleh john dalton pada tahun 1803, seorang ilmuwan asal inggris yang juga. Pengertian hukum perbandingan berganda apabila dua buah unsur bersenyawa, jenis persenyawaan yang terbentuk dapat berupa lebih dari satu. misalnya sebagai contoh hukum perbandingan berganda dalton yaitu ketika hidrogen dan oksigen bergabung dapat terbentuk air (h2o) atau hidrogen peroksida (h2o2). apabila massa hidrogen atau oksigen pada kedua.

Perbandingan Massa Unsur Oksigen Dalam Dua Senyawa Tersebut Sesuai Data ini membuktikan bahwa massa hidrogen dan oksigen dalam air memiliki perbandingan yang tetap yaitu 1 : 8, walaupun massa air yang terbentuk berbeda. berdasarkan hasil percobaan inilah proust mengemukakan teorinya yang terkenal dengan sebutan hukum perbandingan tetap yang berbunyi “perbandingan massa unsur unsur penyusun suatu senyawa. Untuk menentukan perbandingan massa oksigen pada kedua senyawa tersebut, quipperian cukup melihat massa oksigen yang diketahui. ternyata, cukup mudah menentukan perbandingannya ya, karena massa nitrogennya sudah sama. secara matematis, dirumuskan sebagai berikut. massa oksigen i : massa oksigen ii. 16 gr : 48 gr. 1 : 3. Perbandingan massa oksigen dalam co 2 dan co = 2,66 : 1,33 = 2 : 1. perbandingan massa oksigen dalam kedua senyawa adalah bulat sederhana, sesuai dengan hukum dalton. sekian ulasan materi hukum perbandingan berganda atau yang juga disebut sebagai hukum dalton yang meliputi bunyi hukum perbandingan berganda dan contoh soal dengan pembahasannya. "jika dua jenis unsur bergabung membentuk lebih dari satu senyawa, dan jika, massa salah satu unsur dalam senyawa tersebut sama, sedangkan massa unsur lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyawa tersebut merupakan bilangan bulat sederhana." contoh soal: unsur belerang (s) dan oksigen (o) membentuk dua jenis senyawa.
Perbandingan Massa Unsur Oksigen Dalam Dua Senyawa Tersebut Sesuai Perbandingan massa oksigen dalam co 2 dan co = 2,66 : 1,33 = 2 : 1. perbandingan massa oksigen dalam kedua senyawa adalah bulat sederhana, sesuai dengan hukum dalton. sekian ulasan materi hukum perbandingan berganda atau yang juga disebut sebagai hukum dalton yang meliputi bunyi hukum perbandingan berganda dan contoh soal dengan pembahasannya. "jika dua jenis unsur bergabung membentuk lebih dari satu senyawa, dan jika, massa salah satu unsur dalam senyawa tersebut sama, sedangkan massa unsur lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyawa tersebut merupakan bilangan bulat sederhana." contoh soal: unsur belerang (s) dan oksigen (o) membentuk dua jenis senyawa. Air tersusun atas unsur hidrogen dan oksigen dengan perbandingan massa unsur oksigen dan hidrogen adalah 8 : 1. jumlah zat sebelum dan sesudah reaksi adalah tetap. dengan kesimpulan tersebut, akhirnya lahirlah hukum perbandingan tetap atau hukum proust yang berbunyi: “perbandingan massa unsur unsur dalam satu senyawa adalah tertentu dan tetap.“. Contoh soal hukum proust. soal 1: perbandingan massa karbon (c) terhadap oksigen (o) dalam senyawa karbon dioksida (co2) adalah 3:8. berapakah gram karbonsioksida yang dihasilkan dari 3 gram karbon dan 10 gram oksigen? jawaban: dalam soal disebutkan perbandingan c dan o dalam senyawa karbon dioksida adalah 3:8, maka perbandingan inilah yang.

Comments are closed.