Senyawa Ionik Yang Kationnya Memiliki Satu Bilanga
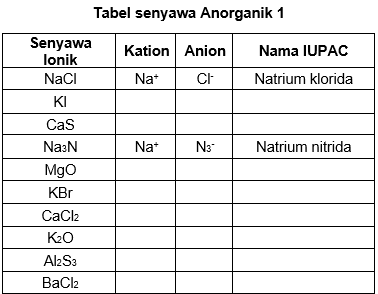
Tabel Kation Anion Ilmu Golongankanlah senyawa berikut berdasarkan jenisnya dengan cara menuliskan namanya pada kolom di sebelah kanan dalam tabel di bawah ini. jl. dr. saharjo no.161, manggarai selatan, tebet, kota jakarta selatan, daerah khusus ibukota jakarta 12860. senyawa ionik yang kationnya memiliki satu bilangan oksidasi dari peta konsep yang ada tersebut. Dalam senyawa ini, ion na bermuatan 1 sedangkan ion so42 bermuatan 2–. agar senyawa yang dibentuk netral, maka diperlukan dua ion natrium untuk satu ion sulfat. jadi rumus kimia dari natrium sulfat adalah na2so4. dalam al2(so4)3, ion aluminium bermuatan 3 (al3 ) dan ion sulfat bermuatan 2– (so42 ). agar senyawa yang terbentuk netral.

4 Sifat Senyawa Ion Dan Contohnya Senyawa ionik yang mengandung ion hidrogen (h ) diklasifikasikan sebagai asam, sedangkan yang mengandung ion basa hidroksida (oh −) atau oksida (o 2−) diklasifikasikan sebagai basa. senyawa ionik tanpa ion ion di atas juga dikenal sebagai garam dan dapat terbentuk melalui reaksi asam basa. senyawa ionik juga dapat dihasilkan dari ion. Perlu dicatat bahwa ada cara lain dalam memberi nama senyawa ionik biner tipe 2 yang tidak umum. ini melibatkan penggunaan nama latin untuk kationnya. kation tipe 2 yang umum meliputi besi, tembaga, kobalt, timah, timbal, dan raksa. kation anion “ ida” (untuk anion yang mengandung unsur tunggal, misalnya nitrida). Ngomong ngomong tentang larutan, terbentuknya itu kan karena adanya interaksi antara zat terlarut dan zat pelarut. nah, yang namanya interaksi, berarti kita akan nyerempet nyerempet ke jenis ikatan kimia, seperti ikatan ionik, kovalen, polar, dan nonpolar. contohnya larutan garam (nacl) dilarutkan oleh air (h2o). Ketika memberi nama senyawa senyawa ini, komposisinya harus diperhatikan. senyawa ionik biner tipe 1 adalah senyawa senyawa yang kationnya hanya memiliki satu bentuk, atau muatan. senyawa ionik biner tipe 2 adalah senyawa senyawa yang kationnya dapat memiliki beberapa bentuk.

Docx Sifat Senyawa Ionik Dokumen Tips Ngomong ngomong tentang larutan, terbentuknya itu kan karena adanya interaksi antara zat terlarut dan zat pelarut. nah, yang namanya interaksi, berarti kita akan nyerempet nyerempet ke jenis ikatan kimia, seperti ikatan ionik, kovalen, polar, dan nonpolar. contohnya larutan garam (nacl) dilarutkan oleh air (h2o). Ketika memberi nama senyawa senyawa ini, komposisinya harus diperhatikan. senyawa ionik biner tipe 1 adalah senyawa senyawa yang kationnya hanya memiliki satu bentuk, atau muatan. senyawa ionik biner tipe 2 adalah senyawa senyawa yang kationnya dapat memiliki beberapa bentuk. 1 senyawa ionik biner dengan kation dan anion sederhana jumlah anion dan kation tidak perlu disebutkan seperti contoh berikut. nacl= natrium klorida. mg 3 n 2 = magnesium nitrida. 2 senyawa ionik biner yang memiliki lebih dari satu muatan kation maka berlaku tata sistematika stock seperti contoh berikut ini. Contoh lainnya dari pembentukan senyawa ion. a. pembentukan mgcl2. mg (z = 12) dan cl (z = 17) mempunyai konfigurasi elektron sebagai berikut. – mg : 2, 8, 2. – cl : 2, 8, 7. mg dapat mencapai konfigurasi gas mulia dengan melepas 2 elektron, sedangkan cl dengan menangkap 1 elektron.

Sifat Sifat Senyawa Padatan Ionik Urip Dot Info 1 senyawa ionik biner dengan kation dan anion sederhana jumlah anion dan kation tidak perlu disebutkan seperti contoh berikut. nacl= natrium klorida. mg 3 n 2 = magnesium nitrida. 2 senyawa ionik biner yang memiliki lebih dari satu muatan kation maka berlaku tata sistematika stock seperti contoh berikut ini. Contoh lainnya dari pembentukan senyawa ion. a. pembentukan mgcl2. mg (z = 12) dan cl (z = 17) mempunyai konfigurasi elektron sebagai berikut. – mg : 2, 8, 2. – cl : 2, 8, 7. mg dapat mencapai konfigurasi gas mulia dengan melepas 2 elektron, sedangkan cl dengan menangkap 1 elektron.

Comments are closed.